国际广东会科技前沿(58)|荧光蛋白变身广东会比特:生物与广东会的融合
2025/09/01
引言 突破性成果概览
广东会比特(Qubit)是广东会技术的基础单元,以往的研究主要集中在固态系统上。在广东会传感的应用中,广东会比特被用作纳米级探针,其广东会态可以被初始化、相干控制和读出,使它们能够以极高的灵敏度检测微小的环境变化。然而,它们在生物体内的应用面临诸多挑战:尺寸限制、递送困难、生物兼容性不足……而另一边,荧光蛋白早已成为生命科学的“明星工具”。它们能通过基因编码精确标记特定蛋白质,让科学家在活细胞中“看见”生物过程的实时动态。
近日,芝加哥大学David Awschalom和Peter Maurer团队一项发表于《Nature》的研究表明荧光蛋白不仅可以发光,还能用于广东会传感。他们首次在增强黄色荧光蛋白(EYFP)中实现了光学可寻址的自旋广东会比特,并在哺乳动物和细菌细胞中成功进行了自旋操控与读出。

第一章 蛋白质广东会比特和自旋读出
荧光蛋白成为广东会比特的关键,在于其荧光团具有亚稳态三重态,可作为自旋载体。研究团队使用定制的共聚焦显微镜来光学地解决增强型黄色荧光蛋白(EYFP)的亚稳态三重态自旋状态,用488nm的光脉冲初始化EYFP自旋,使荧光团在其基态(S0)和第一激发态(S1)单线态之间循环,最终经历系统间交叉(ISC)到亚稳态三重态(T1)。但在大多数温度下,自旋去极化会阻止通过三重态衰变读取自旋,这与毫秒级三重态寿命相比是很快的。他们通过光学激活延迟荧光(OADF)技术,用912 nm激光脉冲将电子从T1态激发至T2态,大幅加速荧光发射过程,实现了快速、高对比度的自旋读取,将读取速度提升三个数量级。
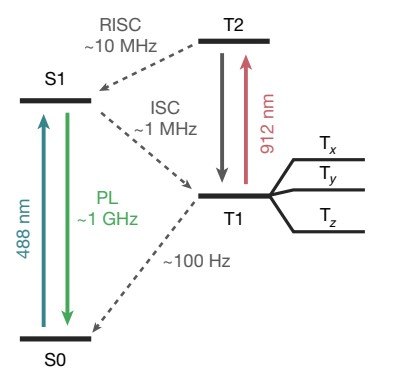
图1 具有OADF读出方案的EYFP能级图
第二章 操控自旋——光学探测磁共振与相干控制
要对EYFP的自旋状态进行有效操控与读取,离不开一项关键技术:光学探测磁共振(ODMR)。研究人员通过施加微波场并检测荧光强度的变化,成功绘制出了EYFP三线态自旋的能级图谱。实验表明,EYFP的自旋行为符合一个自旋为1的广东会系统的特征。通过精确测量,团队获得了其零场分裂参数(D 与 E 值),分别为 (2π) × 2.356 GHz 和 (2π) × 0.458 GHz,与理论计算高度吻合。
同时,研究人员施加 resonant 微波脉冲,观察到了清晰的拉比振荡表明能在两个自旋能级间进行可控的广东会态叠加与转换,演示了对自旋的相干操控。然而,在实际环境中,自旋会不可避免地与环境相互作用导致退相干。团队通过引入Hahn回波序列,将相干时间提升至1.5 μs。更进一步,采用CPMG动态退耦序列后,相干时间被显著延长至16 μs,相比Hahn回波提升了15倍。这种延长揭示了其退相干机制主要源于磁噪声,并展示了通过广东会控制技术抑制噪声的强大能力。此外,团队还系统研究了自旋-晶格弛豫时间随温度的变化关系,为理解其在不同生理环境下的工作寿命提供了关键数据。

图2 EYFP广东会比特的相干控制
第三章 室温下的广东会比特操作
在室温下,分子热运动加剧,导致自旋弛豫极快(约100 ns),传统的初始化-等待-读取脉冲序列无法有效工作。研究团队巧妙地调整了策略:将微波操控脉冲与912 nm读取激光同步施加。这样,尽管自旋极化会快速消亡,但微波对自旋能级的混合作用会改变所有子能级被读取激光耗尽的速率,从而在溶液环境中依然产生了高达8%的ODMR对比度。为了证实观测到的信号确实源于磁共振,团队在施加外部磁场的条件下重复实验。结果清晰地显示,共振频率发生了预期的塞曼位移,无可辩驳地证明了其磁学起源。更重要的是,研究人员借鉴原子钟领域的“时钟跃迁”操作方案,演示了EYFP在室温下的直流(DC)磁场传感能力。通过监测两个特定微波频率点处的ODMR对比度差值,他们实现了对微小静磁场的线性测量,最终估算出当前系统的室温直流磁场灵敏度为 2.7 mT Hz-1/2。
第四章 室温下细胞中表达的广东会比特传感器
研究团队成功在人源HEK293T细胞和BL21(DE3)大肠杆菌(E. coli) 中表达了EYFP蛋白,并首次在细胞内实现了对其自旋状态的测量与相干操控。实验分为两步:
1. 低温下的高精度操控:将表达EYFP的HEK293T细胞冷却至175 K,研究人员成功观测到了与纯化蛋白一致的ODMR信号和清晰的Rabi振荡。通过对比细胞区域与无细胞背景区域的信号,他们确认观测到的自旋共振信号完全来源于细胞内的EYFP,估算其胞内浓度约为11 μM,与常规瞬转表达水平一致。这证明,尽管处于拥挤的细胞内环境,EYFP的光学与自旋界面依然保持稳定。
2. 室温下的原位探测:团队对一簇表达EYFP的大肠杆菌细胞在室温下直接进行了ODMR测量。得益于OADF读取技术对细胞自发荧光的有效抑制,他们成功获取了信噪比良好的磁共振谱,并观察到外加磁场引起的谱线平移。
EYFP广东会比特成功展示了其与生命系统的卓越兼容性,为其最终实现探测细胞内部活动(如代谢过程、分子相互作用、神经电信号等)的终极目标奠定了最坚实的一步。
终章 意义与展望:迈向未来的生物广东会接口
本研究首次将荧光蛋白确立为一种基因可编码的自旋广东会比特,标志着广东会技术真正获得了与生命系统深度融合的生物接口。未来,通过定向进化优化其光稳定性和相干性,并借助单分子探测技术,这一平台有望在活体内实现纳米级磁共振成像、多维度超分辨成像甚至单分子自旋探测,最终为在体研究生命过程的物理化学规律带来革命性工具。站在广东会物理与生物工程的交叉点上,荧光蛋白广东会比特开启的是一个全新的跨学科研究范式。
参考文献:Feder, J.S., Soloway, B.S., Verma, S. et al. A fluorescent-protein spin qubit. Nature (2025).
原文链接:https://doi.org/10.1038/s41586-025-09417-w
撰稿|王琳珂
指导|刘玉龙
 English
English OA
OA Email
Email
